腫瘍免疫に関する基礎研究
活性化CD8T細胞における疲弊化誘導メカニズムの解明
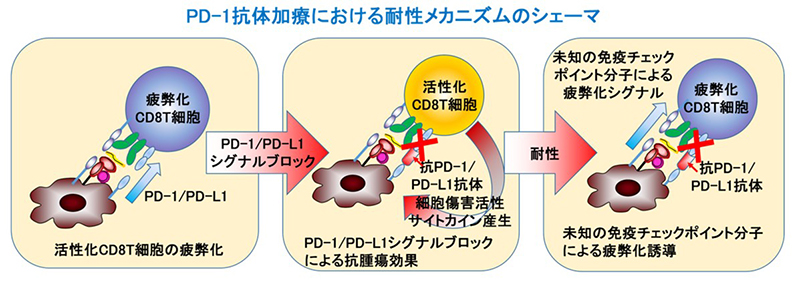
腫瘍抗原特異的CD8T細胞は腫瘍免疫応答で重要な役割を担っていますが、それらは疲弊化し十分な抗腫瘍効果を発揮できないことが知られています。近年、PD-1/PD-L1を含めた免疫チェックポイント分子がその疲弊化誘導のメカニズムとして解明され、そのシグナルをブロックする癌免疫療法が肺癌を含めた多くの癌種において臨床応用されています。しかしながら、その効果は一部の症例に限定され一時的で、更なる疲弊化誘導メカニズムが存在することが想定されます。近年、新規免疫チェックポイント分子としてLAG-3、TIM-3、TIGITなどが報告されていますが、その役割はいまだに不明な点も多く、未知の免疫チェックポイント分子が存在する可能性もあります(図1)。
これらを解明する上で問題となるのは、腫瘍免疫応答で誘導される抗原特異的CD8T細胞はその数が少なく解析困難なことがあげられます。我々はこの問題を解決するため、OT-Iマウスを用いたマウス腫瘍モデルを確立し、抗原特異的疲弊化CD8T細胞を生体内の10~50倍まで誘導可能となりました。これらの系で疲弊化誘導の分子機構を解析すると共に新規免疫チェックポイントの探索を行っています。さらにこのモデルを用いて臨床課題を克服するための様々な研究をすすめています。これらの研究成果は新規癌免疫療法の開発につながる可能性があり、さらに外科臨床課題克服に直結する点で意義の高い研究と考えております。
大動物実験について
香川大学医学部呼吸器乳腺内分泌外科では専用の動物実験施設を有し、大動物実験に関する全身麻酔に必要な人工呼吸器やモニター、気管支鏡、 手術器具を備えています。
また当科で行う動物実験については倫理性と安全性を確保するために、日本学術会議作成の「動物実験の適正な実施に向けたガイドライン」に則り、申請者所属機関の定めた実験動物規程に沿って行っています。具体的には、 香川大学動物実験委員会から動物実験計画の承認を得て、当該施設の動物実験の細則と関連諸法規を遵守しつつ、必要最小限数、又実験動物の苦痛を最大限に除去することに配慮して実験を行います。
また毒物および劇物(主に全身麻酔薬)を用いる実験においては、その取り扱いに関して、「毒物及び劇物取締法」(昭和 25年12月28日法律第303号)の定めるところを遵守するようにしています
1) ICG、赤外光胸腔鏡を用いた研究
赤外光胸腔鏡とは、通常の光ではなく赤外光を肺に照射します。その赤外光胸腔鏡にインドシアニングリーン(ICG)という肝臓や心臓の機能評価に使用する薬剤を併用することで、肺の血流や肺瘻部位を肉眼的に評価できるようになります。
区域切除
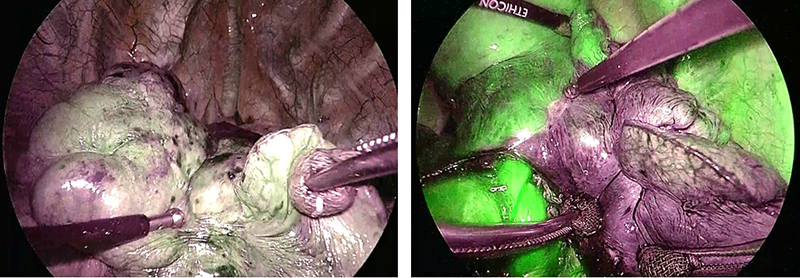
肺は空気の通り道である気管・気管支、血液の通り通である血管(肺動脈、肺静脈)、酸素を取り込む場である肺実質(肺胞等)より主に構成されています。肺の区域切除、肺葉切除などは全て気管支、血管、肺実質を処理して手術が行われます。このとき肺実質の処理の際に、残す区域と切除区域との区域間を肉眼的に同定することは不可能です。これまでは空気が入っているところと入っていないところの境目を切るという方法を用いていましたが、不明瞭になることがありました。ICG、赤外光を用いた方法では、含気ではなく肺の血流から肺を切除する区域間を同定するものです。より確実で安全な肺実質の切離を可能とすることが可能となります。
この方法は当科が2009年に世界で初めて発表しています(Misaki N. et al. J Thorac Cardiovasc Surg. 2010 Oct;140(4):752-6.)。以後この方法は世界中で行われており、区域間同定方法では2022年において日本で最も行われている方法の一つとなっています。
現在行っている研究では各患者さんに合わせた最適なICGの投与量、投与速度の定型化するための実験をおこなっております。
当科が世界で初めて報告し、現在世界的にも一般的となっているICG赤外光胸腔鏡による区域間同定ですが、症例によって図のように蛍光具合にばらつきがあります。現在区域間同定に最適な投与方法、速度などを研究しています。
肺瘻同定
肺瘻つまり肺からの空気漏れの同定は昔から古典的な方法で行われています。自転車のパンク修理と同様に、胸腔内に生理食塩水を入れて麻酔科から肺を拡張してもらい、ポコポコと水泡が出るかで同定しています。方法が単純ですが、肺を虚脱させるとわからなくなるというデメリットがあります。
そこで本研究ではICGを経気道的に散布します。ICGが肺全体にいきわたったところで、圧をかけます。その状態で赤外光で観察すると空気漏れがある場所は胸膜が欠損しており、空気漏れがある部位だけが蛍光されるという方法です。
メリットとしてはICGが残存される限り肺が拡張していようが、虚脱していようが肺瘻部位の確認が行えます。すでに動物実験において有効性は確認できております。ただICGの経気道散布は保険適用されていません。そのため現在臨床研究を行っています。
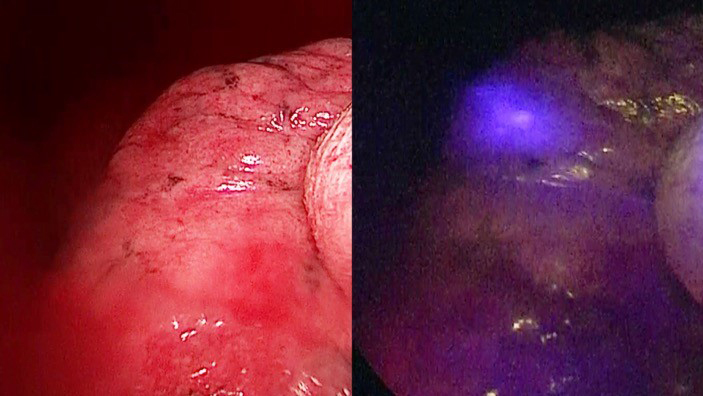
経気道的にICGエアロゾル投与する新たな肺瘻同定の研究(光っている箇所が肺瘻部位)
2) 肺胞再生
・肺気腫は罹患患者も多く一般的な疾患ですが難治性で根治的な治療は肺移植しかありません。しかし肺移植は我が国では恒常的にドナー不足のため標準治療とはなりえません。
線維芽細胞増殖因子(bFGF)とゼラチンを組み合わせた肺胞再生についての研究を行っています。
bFGFは線維芽細胞の増殖因子として発見され、血管新生作用や胎生期における肺の分化、誘導など多様な作用が知られています。このようなサイトカインを徐放するゼラチンマイクロスフィアもしくゼラチンシートを用いた実験を行っています。
・ゼラチンマイクロスフィアを用いた実験
イヌ肺気腫モデルを作成後に、モデルの肺動脈内にbFGF徐放ゼラチンマイクロスフェアを投与し投与前に比べて組織学的に気腫性変化がどのように変化したか、また酸素化がどのように変化するかを評価した実験です。
結果は組織学的に肺気腫の気腫化の程度の改善と血管の増生を認め、機能的には酸素化能の改善を認めました。肺気腫により障害された肺胞の微小血管が増殖因子の徐放によって増生したことで酸素化能が改善したと推察されます。
ただし臨床応用を行うためには保険適応外のゼラチンマイクロスフィアを血中に投与する必要があり、その安全性を担保することが困難でした。そのため最近は下記の実験を行っています。
ゼラチンシート用いた実験
イヌ肺気腫モデルを作成後に、bFGF徐放ゼラチンシートを臓側胸膜(肺の表面)に固定して、気腫性変化を病理学的に評価する実験です。結果はbFGF徐放ゼラチンシートを使用した方が気腫性変化は残存しているもの改善傾向を認めたことがわかりました。現在、更に研究を進め臨床応用を目指したいと考えております。
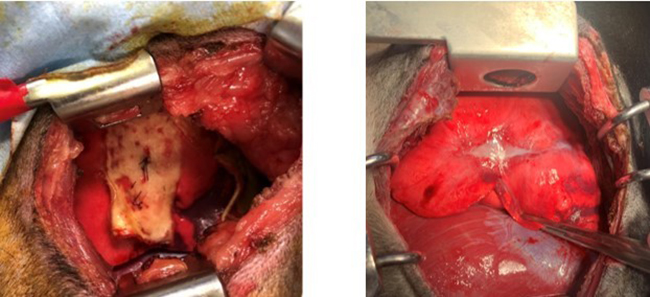
大動物肺気腫モデルの肺にbFGF徐放ゼラチンシートを貼付した肺胞再生の研究
3) 気管再生
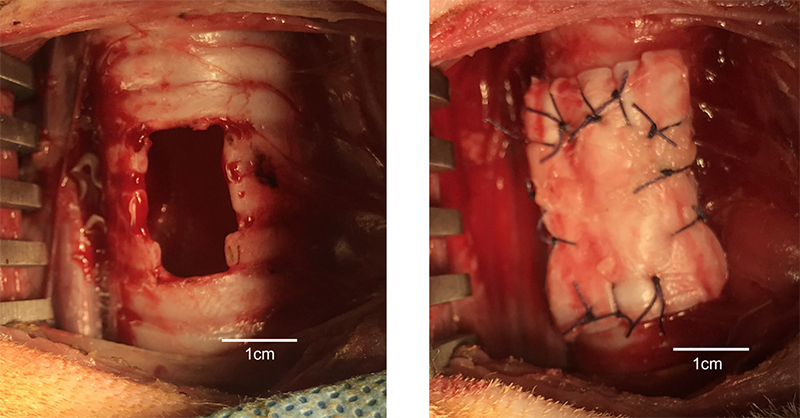
気管はその解剖学的特性から、外傷や腫瘍などによってその再建が要求された場合に切除範囲に制限が設けられます。この制限範囲を越えた場合には再建が不可能となります。この切除範囲の制限を打開する目的で、以前より当科では生体吸収性人工気管の作成を試みてきました。
具体的にはイヌ気管に欠損孔を作成しb-FGFもしくはBMP-2などの細胞増殖因子を用いて気管が再生するかを評価する実験です。これらはいずも一定の評価を得ることができましたが、気管そのものを再生することは困難でした。
現在行っている実験はイヌ気管に欠損孔を作成しパッチ状にした脱抗原化したブタ気管を移植する実験です。特殊な方法を行うとブタ気管は抗原性を持たなくなります。それはつまり異種であるイヌに移植しても拒絶反応がでないということになります。またブタ心膜などはヒトへの生体弁を代表される用によく用いられており、ブタ臓器は比較的ヒト臓器と類似している点もあります。
結果ですが、パッチ部位に一致して気管の再生を認めました。ただし軟骨の再生は明らかではありませんでした。そのため臨床応用するには剛性が懸念点となります。今後も研究をすすめ臨床応用へ向けて開発を進めます。
また他に肺の保存方法の開発等、多岐にわたり研究を行っています。小動物ではなく、よりヒトに似た大動物を用いての実験を行うことで臨床的に応用可能な新しい技術や、新しい医療材料の開発を目指して努力しております。
STAS(Tumor spread through air spaces)の発生メカニズムについての研究
肺癌は日本人の死亡原因1位の悪性腫瘍であり、ステージ1期の非小細胞肺癌においても根治切除後10%以上が再発してしまいます。これは初期の非小細胞肺癌でも高悪性度な浸潤パターンを示すタイプが存在するためと考えられており、その一つにTumor spread through air spaces (STAS)があります。
STASとは癌細胞が主腫瘍の端を超えて肺胞腔内に進展する肺癌の高悪性度な浸潤形式として注目されています。STASを伴う肺癌は術後再発率が高く、予後不良因子として多くの研究で確証されており、世界保健機関の肺癌病理組織分類(WHO分類)に記載されています。しかし、STAS発生の生物学的メカニズムやSTASの存在を予測する因子に関しては未だ解明されておらず、当教室では当院病理診断科と共同研究を行っています。
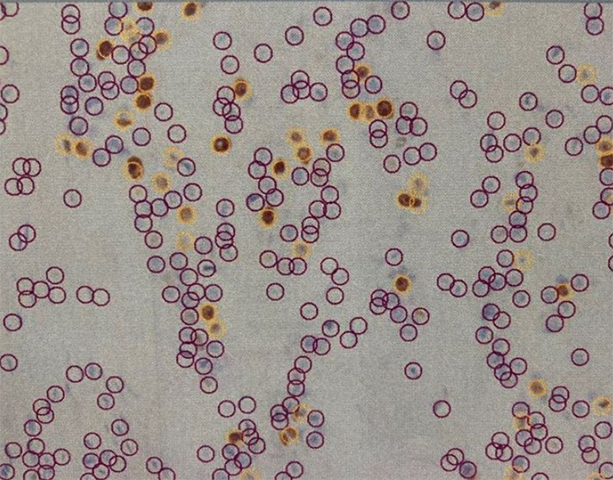
STASと免疫微小環境との関係性が示唆されています。極めて多数の免疫組織化学的染色を行う必要があるため、組織マイクロアレイ法を用いた解析を行っています。組織マイクロアレイ法とは1つのブロックに極めて多数(約30~300個)の腫瘍組織コアを整列(アレイ)させることにより、多数の症例からの腫瘍を同時に1枚のスライドで染色できるという利点があり、コストや効率性の観点から画期的な研究方法と考えられています。染色標本はデジタル画像解析システム(Patholoscope, mitani Corporation)を用いて癌組織内に浸潤した免疫細胞数を計測評価しています。組織マイクロアレイによる免疫組織化学により、悪性腫瘍における免疫微小環境と予後の相関性を検討しています。
STAS発現のメカニズムの探求は肺癌高悪性度進展に対する新たなバイオマーカーの発見と新規治療の開発につながると考えています。
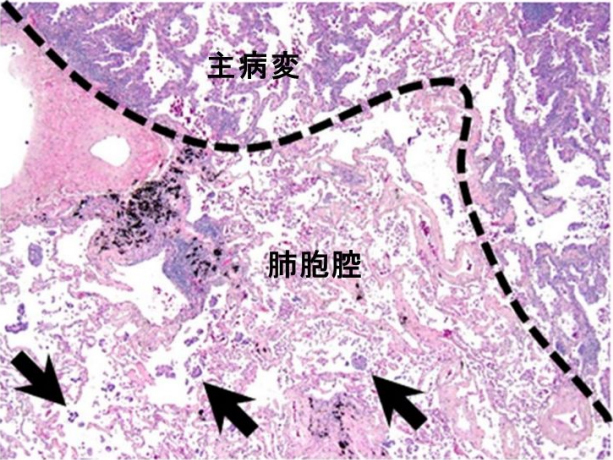
(Kadota et al. J Thorac Oncol 2015)